当用一离子选择感应膜将两种溶液隔开时,则在这两种溶液之间产生一定的电位差,即所谓的膜电位。
膜电位的测定是离子选扦性电极分析的基础,但是,它是无法直接测量的,只能从完整的电化学电池的电动势推算出来。为了从电池电动势求出膜电位,常在膜两侧的溶液I利n中分别插入电位恒定的参比电极A和B,组成一电化学电池:

二、活度与浓度
离子选择性电极的电位与溶液中待测离子活度的对数值成线性关系,然而在一般的分析中,关心的往往是离子的浓度,因此需要了解活度与浓度之间的关系。
由强电解质理论可知,强电解质在溶液中离解后,由于静电引力,在每个离子周围吸引着相当数量的相反电荷的离子,使离子间互相牵制,不能完全自由地运动。因此已离解的离子不能充分发挥其作用,在导电性和参加化学反应的能力等方面,其效果与没有完全离解相似。
为了校正实际溶液对理想溶液的这种偏差,采用有效浓度即活度来表示。从这一意义上说,活度就是已经校正了离子间相互作川的浓度。活度。和浓度c之间的关系为:
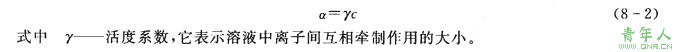
三、活度系数与离子强度
溶液中—种离子的活度系数不仅受其本身的浓度和电荷数的影响,同时也受到溶液中其他各种共存离子的浓度和电荷数的影响,但与离子的种类无关。这种影响川“离子强度”表示。离子强度的定义为: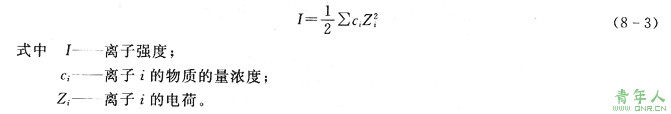
四、总离子强度调节缓冲液
在离子选择性电极分析中,试样溶液的组成情况往往十分复杂,很难通过活度系数来计算待测离子的浓度,因此常常采用恒定离子强度的方法,即同时往试样溶液和标准比对溶液中添加大量惰性电解质,以使溶液的离子强度维持恒定。此时,可以认为溶液中的活度系数为一常数,直接以浓度来表示:来源:考试大
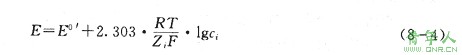
这种由惰性电解质配制得到的离子强度的缓冲溶液,通常称之为"TISAB"(总离子强度调节缓冲液)。在某些情况下,共存于试样溶液中的其他离子有与待测离子形成难离解分子的倾向,如弱酸、弱碱、难溶性沉淀和配合物等,这时可在T1SAB中配人pH值缓冲液和配位剂,以消除共存干扰离子的影响。典型的例子是在直接测定自来水和其他介质中氟的总浓度时所用的TISAB,其组成如表8—1所示。
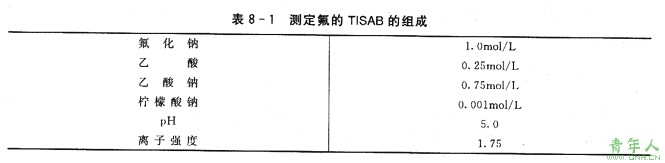
在使用时,缓冲溶液和等体积的试样溶液混合,由于离子强度很高,因而待测溶液和标准溶液的活度系数事实上相同。同时,TISAB中乙酸-7,酸钠缓冲液,又为氟电极提供了最适宜的pH值范围。少量柠檬酸钠的加入,是为了将已生成AIF,FeF配离子的那部分氟置换出来,以保证它以游离的状态存在。
责任编辑:sealion1986