配制: 取盐酸9.0ml,加水适量使成1000ml,摇匀。
标定: 取在270℃~300℃干燥至恒重的基准无水碳酸钠约0.15g,精密称定,加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。每1ml的盐酸滴定液(0.1mol/L)相当于5.30mg的无水碳酸钠,根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
无水碳酸钠在270℃~300℃干燥的目的是除去其中少量的水分和NaHC03,NaHC03在此温度下可分解为Na2C03。
滴定至近终点需煮沸2分钟,是因为此时溶液中有大量H2CO3,和NaHC03,形成缓冲对,使终点不敏锐。若加热煮沸可使H2C03分解为C02和H20而除去。
盐酸滴定液浓度的计算方法为:
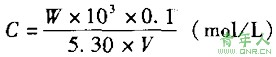
W——无水碳酸钠的称样量(g);
V——标定时消耗盐酸滴定液的体积(ml)。
责任编辑:刀刀